Консервация вместо реставрации
Михаил Сафронов
Промывка археологического железа при помощи
р-р натрия гидроксида и натрия сульфита
![]() Хлориды
железа (FeCl2 - 4 H2O и FeCl2 - 2 H2O) хорошо растворимы в воде. С
повышением температуры растворимость повышается. Так, например,
растворимость FeCl2 при 100˚ С составляет 92 г/100 г воды. Повышая
температуру с 20˚ С до 100˚ С, растворимость улучшается на 47 %. Но,
существует одно �но�. После того, как находка извлечена из земли, хлорид
железа находящийся в продуктах коррозии под действием кислорода и влаги
преобразуется в акагенит
FеО(ОН)[1].
Точнее сказать, хлорид железа встраивается в кристаллическую решётку
акагенита и точная формула будет FеО(Cl,
ОН).
Хлориды
железа (FeCl2 - 4 H2O и FeCl2 - 2 H2O) хорошо растворимы в воде. С
повышением температуры растворимость повышается. Так, например,
растворимость FeCl2 при 100˚ С составляет 92 г/100 г воды. Повышая
температуру с 20˚ С до 100˚ С, растворимость улучшается на 47 %. Но,
существует одно �но�. После того, как находка извлечена из земли, хлорид
железа находящийся в продуктах коррозии под действием кислорода и влаги
преобразуется в акагенит
FеО(ОН)[1].
Точнее сказать, хлорид железа встраивается в кристаллическую решётку
акагенита и точная формула будет FеО(Cl,
ОН).
При образовании этого соединения происходит увеличение объёма продуктов коррозии, что приводит к появлению трещин, а в дальнейшем и к расслаиванию. Приостановить образование акагенита возможно, если, например, относительная влажность будет меньше 20 %.[2]
![]() Кроме
хлоридов, в слоях коррозии присутствуют и другие соли, такие как
нитраты, сульфаты и фосфаты. Сульфаты являются наиболее агрессивными и
способствуют коррозии.
Кроме
хлоридов, в слоях коррозии присутствуют и другие соли, такие как
нитраты, сульфаты и фосфаты. Сульфаты являются наиболее агрессивными и
способствуют коррозии.
Так, например, арматура из железа находящаяся в гипсе очень быстро покрывается налётом ржавчины. Фосфаты и карбонаты оказывают пассивирующее воздействие на железо. Они образуют плохо растворимый слой. Но, если этот слой неоднороден или нарушен, то коррозия будет протекать дальше.
В только что выкопанных находках соли хлорида присутствуют в более-менее свободном состоянии и довольно легко растворимы. Но, со временем они преобразуются в плохо растворимые соединения, и удалить такие хлориды дистиллированной водой становится практически не возможно.[3] Щелочной р-р повышает растворимость хлоридов находящихся в кристаллической решётке акагенита. К сожалению, процесс растворения таких солей идёт довольно медленно.
![]() Метод удаление солей (промывка) при
помощи р-р натрия гидроксида и натрия сульфита был разработан
австралийцами Нортоном и Пирсом в 1975 году. Этот способ заключается в
промывке археологического железа щелочным раствором. При этом
происходит выравнивание концентрации хлоридов присутствующих в слоях
коррозии и самим раствором. В связи с этим, необходимо постоянно
следить за концентрацией ионов хлора в промывочной жидкости и по мере
надобности заменять раствор. Как уже и было
сказано выше, раствор приготавливается их гидрооксида натрия (NaOH)
и сульфита натрия (Na2SO3)
растворённых в дистиллированной воде.
Метод удаление солей (промывка) при
помощи р-р натрия гидроксида и натрия сульфита был разработан
австралийцами Нортоном и Пирсом в 1975 году. Этот способ заключается в
промывке археологического железа щелочным раствором. При этом
происходит выравнивание концентрации хлоридов присутствующих в слоях
коррозии и самим раствором. В связи с этим, необходимо постоянно
следить за концентрацией ионов хлора в промывочной жидкости и по мере
надобности заменять раствор. Как уже и было
сказано выше, раствор приготавливается их гидрооксида натрия (NaOH)
и сульфита натрия (Na2SO3)
растворённых в дистиллированной воде.
Гидроксид натрия (NaOH) растворяет хлорид (происходит обмен ионов Cl на OH) из кристаллической решётки акагенита. При этом акагенит преобразуется в гётит.
Сульфит натрия (Na2SO3) приостанавливает коррозию (сульфит присоединяет кислород и образует сульфат). При этом оксид железа (II) не переходит в оксид железа (III) и тем самым не засоряются поры и капилляры по которым происходит транспортировка хлоридов.
Для приготовления промывочного раствора нужно растворить в 500 миллилитрах дистиллированной воды 20 г гидроксида натрия (максимум 0,005% Cl) и 63 г сульфита натрия (максимум 0,02% Cl) и довести объём до 1-го литра.[4] Такой раствор пассивирует металлическое ядро. К тому же, способность проникновения в капилляры у щелочного раствора намного выше, чем у обычной воды.
Для ускорения процесса, раствор должен быть подогрет от 30� С до 60� С в зависимости от состояния объекта. Ещё один немаловажный фактор, способствующий диффузии солей - циркуляция раствора.[5]
Важно: промывочный раствор не должен контактировать с воздухом. Для этого, в сосуд закачивается азот.[6] Иначе, сульфит преобразуется в сульфат.
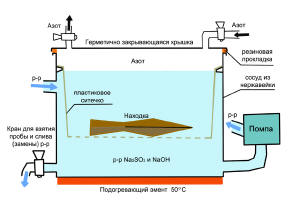
Рис.1. Схематичное изображение устройства для удаления солей.
Картинка открывается щелчком мышки
![]() На
рисунке (рис. 1) изображена приблизительная
схема устройства ванны для промывки археологического железа раствором
гидроксида натрия и сульфита. В качестве ванны используется сосуд из
нержавеющей стали с герметично закрывающейся крышкой. В
На
рисунке (рис. 1) изображена приблизительная
схема устройства ванны для промывки археологического железа раствором
гидроксида натрия и сульфита. В качестве ванны используется сосуд из
нержавеющей стали с герметично закрывающейся крышкой. В
сосуде находится пластиковое ситечко, в которое помещается находка. Так же, можно использовать ситечки из нержавейки. Находки могут располагаться на нескольких уровнях. В устройстве присутствует система создающая циркуляцию жидкости в ёмкости. Для этого, в нижней и верхней части ёмкости, имеются два отверстия (две трубы). Нижняя труба соединена шлангом с помпой. Шланги должны быть устойчивы к воздействию промывочного раствора. В этих целях рекомендуется использовать полиэтиленовые твёрдые шланги (PE-HD) или шланги из полипропилена (PP).[7] Именно по этой трубе происходит откачка раствора из сосуда. Откаченная жидкость поступает снова в сосуд через верхнее отверстие. Так же, в нижней части ванны находится сливной кран, посредством которого происходит взятие проб или удаление раствора. Под металлической ванной находится подогревающий элемент. Для сохранения определённой температуры промывочного раствора необходимо изолировать металлическую ёмкость пенопластом или строительной пеной. Между крышкой и ванночкой присутствует резиновая прокладка, обеспечивающая герметичность системы. В самой крышке расположены два отверстия, через которые подаётся/удаляется азот. В схеме отсутствует термометр, контролирующий температуру промывочного раствора. Для экономии электроэнергии рекомендуется использовать термостат, отключающий подогревательный элемент при достижении нужной температуры.
![]() На первом этапе промывки происходит растворение свободных
хлоридов, которые ещё не были встроены в кристаллическую решётку
акагенита. Уже в первые дни наблюдается увеличение концентрации ионов
хлорида в промывочном растворе. По сравнению со свободным хлоридом,
вымывание хлоридов заключённых в кристаллическую решётку происходит
очень медленно. Если бы не акагенит, то процесс выхода солей из
предмета можно завершить в относительно короткое время.
На первом этапе промывки происходит растворение свободных
хлоридов, которые ещё не были встроены в кристаллическую решётку
акагенита. Уже в первые дни наблюдается увеличение концентрации ионов
хлорида в промывочном растворе. По сравнению со свободным хлоридом,
вымывание хлоридов заключённых в кристаллическую решётку происходит
очень медленно. Если бы не акагенит, то процесс выхода солей из
предмета можно завершить в относительно короткое время.
![]() Какие
объекты не подлежат сульфитно-щелочной промывке? В первую очередь,
предметы, состоящие из нескольких металлов. Так, например, патина
находящаяся на бронзовых и медных частях будет разрушена сульфитом. К
тому же, может произойти миграция ионов меди на железо, в результате
чего железо покроется налётом меди. Можно покрыть медные части
силиконом или другим защитным слоем, но, как правило, это покрытие
лишь уменьшает потери оригинальной поверхности и не останавливает
разрушительный процесс полностью. Для выявления скрытых металлов,
можно использовать рентгеновские снимки объекта.
Какие
объекты не подлежат сульфитно-щелочной промывке? В первую очередь,
предметы, состоящие из нескольких металлов. Так, например, патина
находящаяся на бронзовых и медных частях будет разрушена сульфитом. К
тому же, может произойти миграция ионов меди на железо, в результате
чего железо покроется налётом меди. Можно покрыть медные части
силиконом или другим защитным слоем, но, как правило, это покрытие
лишь уменьшает потери оригинальной поверхности и не останавливает
разрушительный процесс полностью. Для выявления скрытых металлов,
можно использовать рентгеновские снимки объекта.
Помимо составных объектов, не рекомендуется применять этот метод к находкам, на которых присутствуют органические материалы из кости, дерева, ткани или кожи. Лишь объекты, в состав которых входят минерализованные органические остатки, можно без каких-либо последствий подвергать воздействию промывочного раствора.[8]
![]() Толстый слой продуктов коррозии увеличивает время промывки.
Решение о том, насколько должен быть расчищен объект перед промывкой,
зависит полностью от состояния предмета. В том случае, если
поверхность не стабильна, то расчищать предмет перед обессоливанием
без дополнительного закрепления фрагильных участков просто не
возможно. Но в этом случае, закрепительный состав препятствует и
делает невозможным растворения солей на этом участке. Если же, объект
настолько фрагилен, что необходимо обязательно частичное закрепление
фрагментов, то рекомендуется производить пунктуальную фиксацию
эпоксидной смолой или клеем на базе ММА. При этом, смола не должна
проникнуть в поры или трещины. Такие клеи как, цианакрилат (секундный
клей), акриловый клеи и клей на базе полиэстеры разрушаются в
промывочном растворе.
Толстый слой продуктов коррозии увеличивает время промывки.
Решение о том, насколько должен быть расчищен объект перед промывкой,
зависит полностью от состояния предмета. В том случае, если
поверхность не стабильна, то расчищать предмет перед обессоливанием
без дополнительного закрепления фрагильных участков просто не
возможно. Но в этом случае, закрепительный состав препятствует и
делает невозможным растворения солей на этом участке. Если же, объект
настолько фрагилен, что необходимо обязательно частичное закрепление
фрагментов, то рекомендуется производить пунктуальную фиксацию
эпоксидной смолой или клеем на базе ММА. При этом, смола не должна
проникнуть в поры или трещины. Такие клеи как, цианакрилат (секундный
клей), акриловый клеи и клей на базе полиэстеры разрушаются в
промывочном растворе.
![]() В ходе промывки огромное значение имеет постоянный контроль.
Так, например, на протяжении всего процесса в промывочном растворе
должен всё время присутствовать сульфит. Проверить это можно очень
простым способом. Для этого, к небольшому количеству раствора из
ванночки добавляется уксусная кислота в таком количестве, чтобы
индикатор показывал кислую среду. После этого, в пробу вносится
капелька раствора перманганата калия. Если фиолетовый цвет не исчезает
полностью, то весь сульфит был преобразован в сульфат. Если же
капелька раствора перманганата калия стала прозрачной, то в растворе
ещё присутствует сульфит.[9]
В ходе промывки огромное значение имеет постоянный контроль.
Так, например, на протяжении всего процесса в промывочном растворе
должен всё время присутствовать сульфит. Проверить это можно очень
простым способом. Для этого, к небольшому количеству раствора из
ванночки добавляется уксусная кислота в таком количестве, чтобы
индикатор показывал кислую среду. После этого, в пробу вносится
капелька раствора перманганата калия. Если фиолетовый цвет не исчезает
полностью, то весь сульфит был преобразован в сульфат. Если же
капелька раствора перманганата калия стала прозрачной, то в растворе
ещё присутствует сульфит.[9]
Признаком завершения процесса промывки является почти полное отсутствие хлоридов в промывочном растворе. Процесс можно назвать завершённым, если концентрация хлоридов не превышает 5 ррm (примерно 5 мг Cl/ 1 литр р-р).[10] Если в течение нескольких недель не происходит дальнейшее вымывание хлоридов, то рекомендуется остановить процесс промывки. Чем короче срок промывки, тем меньше риск повреждения археологической находки.
Для определения количества хлоридов в растворе существует множество способов. Самый простой из них - тест при помощи нитрата серебра (AgNO3). Для этого капелька промывочного раствора помещается на стекло. Под стекло подкладывается чёрная бумага. Это нужно для того, чтобы образовавшийся в результате реакции светлый осадок хлорида серебра (AgCl) был хорошо заметен на тёмном фоне. После этого, к пробе добавляется капелька нитрата серебра (концентрация: 0,05 N = 0,05 Mol/Liter). При наличии хлорида, в пробе выпадает светлый, практически не растворимый осадок хлорида серебра. Этим методом можно определить наличие хлоридов вплоть до 0,2 мг/литр.
Бумажные индикаторы, применяемые в лабораториях для определения концентрации хлоридов, использовать для теста нельзя. Это связано с тем, что в промывочном растворе кроме хлоридов, присутствуют и другие вещества. В связи с этим, тест при помощи индикатора будет не точным.
Кроме химических способов, для измерения концентрации хлоридов в растворе, применяются приборы, принцип работы которых основан на измерении электропроводимости раствора.
Электропроводимость каждого раствора тесно связана с ионами. Количество тока, проходящего через раствор, находится в прямой зависимости от числа ионов. Поэтому по электропроводимости раствора можно судить о его концентрации. Прибор для определения концентрации, который можно охарактеризовать как измеритель электропроводимости, действует именно на этой основе. Устройство не позволяет производить какие-либо абсолютные измерения и, следовательно, не может указать количество имеющихся в растворе солей в граммах. Это прибор для относительных, то есть сравнительных измерений концентрации раствора. Это означает, что в каждом случае мы сравниваем электропроводимость исходного раствора с электропроводимостью пробы используемого раствора, чтобы сделать из этого сравнения те или иные выводы. При этом надо учитывать, что в промывочном растворе кроме хлорида находятся и другие ионы (SO3, OH, SO4, Na .). В связи с этим, простой прибор не подходит для получения корректного результата. Для поставленной задачи нужно использовать прибор со специальным зондом, реагирующим только на хлориды.
![]() После
того, как процесс вымывания хлоридов будет завершён, необходимо сразу
же тщательно промыть находку от остатков реактивов. В этих целях
используется проточная дистиллированная вода. Для лучшего результата
рекомендуется подогреть воду до 50� С. Если состояние предмета
позволяет, то можно прокипятить находку. Этот процесс должен быть не
длительным, так как предмет в этот момент не защищён от коррозии. Не
рекомендуется проводить промывку несколько дней и тем более оставлять
предмет в дистиллированной воде на неделю.
После
того, как процесс вымывания хлоридов будет завершён, необходимо сразу
же тщательно промыть находку от остатков реактивов. В этих целях
используется проточная дистиллированная вода. Для лучшего результата
рекомендуется подогреть воду до 50� С. Если состояние предмета
позволяет, то можно прокипятить находку. Этот процесс должен быть не
длительным, так как предмет в этот момент не защищён от коррозии. Не
рекомендуется проводить промывку несколько дней и тем более оставлять
предмет в дистиллированной воде на неделю.
![]() После
удаления химических остатков нужно незамедлительно просушить предмет.
О том, как сушить находки вы
сможете прочитать на
следующих страницах.
После
удаления химических остатков нужно незамедлительно просушить предмет.
О том, как сушить находки вы
сможете прочитать на
следующих страницах.
![]() После
завершения работы можно приступить к закреплению и расчистки объекта.
Надо обязательно помнить, что удаления солей из предмета значительно
сокращает риск последующей коррозии, но не останавливает её полностью.
Влага из воздуха может возобновить коррозионные процессы и по этому
необходимо в завершении консервационных/реставрационных работ нанести
защитное покрытие или пропитать находку смолами или воском.
После
завершения работы можно приступить к закреплению и расчистки объекта.
Надо обязательно помнить, что удаления солей из предмета значительно
сокращает риск последующей коррозии, но не останавливает её полностью.
Влага из воздуха может возобновить коррозионные процессы и по этому
необходимо в завершении консервационных/реставрационных работ нанести
защитное покрытие или пропитать находку смолами или воском.
P.S. При работе с химическими реактивами необходимо соблюдать меры предосторожности: использовать специальные резиновые перчатки (см. маркировку) и защитные очки. Перед тем, как вылить промывочный раствор в канализацию, обязательно нейтрализуйте щёлочь и удалите сульфат и сульфит из раствора.
[1] Keller 1969
[2] Turgoose, 1982
[3] S. Greiff und D. Bach, 2000
[4] S. Greiff und D. Bach, 2000
[5] North, 1987
[6] Meier und Tegge, 1996
[7] Krebs und Avondet, 1999
[8] Bach, 1999
[9] S. Greiff und D. Bach, 2000
[10] Loeper-Attia und Weker, 1997
Литература
Bach, D. 1999: Zwei r�mische Hobel& Funktionstechnologische Beobachtung. Trierer Zeitschrift 62, 181-191
Greiff S. und Bach D, 2000: Arbeitsbl�tter, Heft 2. 319-339
Krebs, Chr und Avondet, M.-A. 1999: Langzeitverhalten von Termoplasten (M�nchen, Wien). In: Greiff S. und Bach D, 2000: Arbeitsbl�tter, Heft 2. 319-339
Loeper-Attia, M.-A. und Weker, W. 1997: Dechloruration d,Objets Archeologiques en Fer par la Methode du Sulfite Alkalin a. In: Greiff S. und Bach D, 2000: Arbeitsbl�tter, Heft 2. 319-339
Meier, M und Tegge, C. 1996: Verpakung in Stickstpffgas-eine neue Methode zur Lagerung von arch�ologischen Funden. Berichte zu Denkmalpflege in Niedersachsen, Heft 4, 148-151
North, N. A. 1987: Conservations of metals. In: C. Pearson: Conservation of marine archaeological objects. London. 207 ff
Turgoose, S. 1982: Post-excavation changes in iron antiquities. Stadium in conservation 27. 97-101
Watkinson, D.E. 1983: Degree of mineralization: its significance for the stability and treatment of excavated ironwork. Studies in Conservation 28. 85-90
Источники
1. Schutz arch�ologische Funde aus Metall vor Immissionsbedingter Sch�digung, Stuttgart 2000
2. Herold, Karl: Konservierung von arch�ologischen Bodenfunden, Verlag der �sterreichischen Akademie der Wissenschaften, Wien 1990
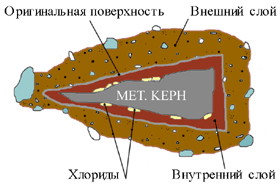
Срез через металлический предмет. Накопление солей внутри продуктов коррозии.

Разрушение находки в последствии последующей коррозии